Actualités
Aelis Farma, société biopharmaceutique à l’origine d’une nouvelle génération de médicaments pour les maladies du cerveau, lance son introduction en bourse sur le marché réglementé d’Euronext Paris
- Augmentation de capital d’un montant d’environ 25 M€, pouvant être portée à un maximum d’environ 33 M€ en cas d’exercice intégral de la Clause d’Extension et de l’Option de Surallocation
- Engagements irrévocables de souscription d’environ 16,5 M€ : 9,8 M€ souscrit par Indivior, un des leaders mondiaux dans le traitement des addictions, et 6,7 M€ par des actionnaires historiques et un nouvel investisseur
- Fourchette indicative de prix de l’offre : 14,02 € à 16,82 € par action
- Période de souscription pour l’offre à prix ouvert du 2 au 14 février 2022 (jusqu’à 17h aux guichets et 20h par internet) et du 2 au 15 février 2022 (jusqu’à 12h CET) pour le placement global
- Titres éligibles au dispositif PEA et PEA PME-ETI
Bordeaux, le 2 février 2022 – 8h CET – Aelis Farma, société biopharmaceutique au stade clinique spécialisée dans le développement de traitements pour les maladies du cerveau (la « Société »), annonce le lancement de son introduction en bourse en vue de l’admission aux négociations de ses actions sur le marché réglementé Euronext Paris (code ISIN : FR0014007ZB4 – mnémonique : AELIS).
L’Autorité des marchés financiers (l’ « AMF ») a approuvé, le 1er février 2022 sous le numéro 22-021 le Prospectus relatif à l’introduction en bourse de la Société, composé d’un document d’enregistrement, approuvé sous le numéro I. 22-003, en date du 14 janvier 2022, d’une note d’opération et d’un résumé du Prospectus (inclus dans la note d’opération).
Aelis Farma, pionnier d’une nouvelle génération de médicaments pour le cerveau
Aelis Farma développe une nouvelle classe de médicaments : les inhibiteurs spécifiques de la signalisation du récepteur CB1 (CB1-SSi) du système endocannabinoïde qui donnent accès à plusieurs domaines thérapeutiques sans traitements disponibles.
En effet, le récepteur CB1 est l’un des récepteurs à neurotransmetteurs les plus exprimés dans le cerveau. Il joue un rôle très important dans la régulation de la physiologie et du comportement et son hyperactivité pathologique est à l’origine de plusieurs maladies du cerveau (déficits cognitifs, addiction, psychose, autisme, trouble d’hyperactivité avec déficit de l’attention – TDAH) et des organes périphériques (obésité, diabète et athérosclérose, fibrose, dystrophie musculaire).
A ce jour, une seule classe pharmacologique a été proposée pour traiter une hyperactivité du CB1 – les antagonistes – une classe pharmacologique avec un mécanisme d’action artificiel qui n’existe pas dans l’organisme. Les antagonistes ont tendance à bloquer complètement l’activité du CB1 et induisent, par conséquent, d’importants effets secondaires qui rendent leur utilisation en clinique difficile, voire impossible, laissant de nombreux patients sans traitement.
Les CB1-SSi développés par Aelis Farma, à la différence des antagonistes, sont les premiers à reproduire un mécanisme naturel, récemment découvert, que le cerveau utilise pour combattre l’hyperactivité du récepteur CB1. Ce mécanisme d’action unique parait permettre aux CB1-SSi d’inhiber uniquement les signaux cellulaires impliqués dans certaines pathologies cérébrales sans perturber l’activité physiologique du récepteur et le comportement normal du sujet – une première en pharmacologie. Cette découverte majeure du co-fondateur et actuel Directeur Général d’Aelis Farma, le Dr. Pier Vincenzo Piazza, alors directeur du Neurocentre Magendie de l’Inserm à Bordeaux, a été publiée dans Science, l’une des plus prestigieuses revues scientifiques.
Aelis Farma a pu montrer dans les essais cliniques qu’elle a menés jusqu’à ce jour que les CB1-SSi sont non seulement efficaces, mais aussi bien tolérés sans effets indésirables à date sur le comportement normal, et pourraient apporter des solutions thérapeutiques à de nombreuses maladies aujourd’hui sans traitement.
Deux premiers candidats-médicaments déjà en essais cliniques dans des indications à forts besoins médicaux insatisfaits
-
AEF0117 pour traiter les effets néfastes de l’usage excessif du cannabis
AEF0117 a déjà fourni des preuves d’efficacité dans un essai clinique de phase 2a pour traiter les troubles liés à la consommation excessive du cannabis, un problème sanitaire et sociétal croissant dans les pays occidentaux, où l’on estime à 17,9 millions le nombre de consommateurs quotidiens ou quasi quotidiens de cannabis. Cette consommation excessive de cannabis s’accompagne d’effets néfastes de plus en plus avérés :
– 7,2 millions de personnes ont été diagnostiquées comme ayant une addiction au cannabis ;
– le nombre d’hospitalisations aux urgences dues aux effets toxiques du cannabis, dont la psychose est la manifestation la plus grave, était de 1,1 million aux Etats-Unis en 2014, et est en augmentation depuis, dépassant aujourd’hui celui lié aux opioïdes ;
– des effets à long terme négatifs sont également observés tant sur le plan cognitif (jusqu’à 8 points de perte de QI) que sur la santé mentale et l’insertion sociale, avec une probabilité jusqu’à 5 fois plus importante de développer des maladies psychiatriques, d’arrêter les études ou de se retrouver au chômage.
Un essai clinique de phase 2b, incluant approximativement 330 patients et dont le protocole a été discuté avec la FDA, démarrera au deuxième trimestre 2022 aux Etats-Unis pour évaluer l’efficacité de AEF0117 dans le traitement de l’addiction au cannabis. L’étude sera coordonnée par son investigateur principal le Pr. Frances Levin de l’Université de Columbia. Le programme de phase 2 de AEF0117, visant à rendre ce composé prêt à rentrer en phase 3, a reçu un financement de l’Institut National de la Santé Nord-Américain (NIH) de 4,5 M$.
Sur la base des résultats de l’essai clinique de phase 2a, Aelis Farma a signé en juin 2021 un accord d’option de licence exclusive avec Indivior PLC, pour le développement et la commercialisation de AEF0117 comme traitement des troubles liés à une consommation excessive de cannabis (cf. § « Un partenariat mondial… » ci-après).
-
AEF0217 pour traiter divers déficits cognitifs, notamment ceux du syndrome de Down (Trisomie 21)
AEF0217 pourrait devenir le premier traitement des déficits cognitifs causés par une hyperactivité du récepteur CB1, et en première indication ceux associés au syndrome de Down (Trisomie 21). Le syndrome de Down est une condition génétique qui touche 0,8 million de personnes dans les principaux pays occidentaux et au Japon, avec une prévalence en progression en raison de l’augmentation significative, lors des dernières décennies, des grossesses tardives et de l’espérance de vie des personnes vivant avec ce syndrome. Il n’existe à ce jour aucun traitement pour les troubles cognitifs associés au syndrome de Down qui constituent un important besoin médical non satisfait et une charge significative pour les personnes porteuses de ce syndrome, pour leurs familles et pour les systèmes de santé.
Au cours des études précliniques (modèles murins de Trisomie 21), AEF0217 a permis de restaurer le déficit de la mémoire de travail, trouble cognitif clé du syndrome de Down, sans induire d’effets secondaires comportementaux ou physiologiques identifiables. Grâce à cette combinaison unique d’efficacité et d’innocuité, particulièrement importante pour la population fragile des trisomiques, AEF0217 pourrait représenter une avancée majeure dans la qualité de vie et l’intégration sociale des personnes vivant avec le syndrome de Down.
AEF0217 est actuellement évalué dans des études cliniques de phase 1 menées chez des volontaires sains, sans qu’aucun effet indésirable significatif n’ait été signalé à ce jour dans les trois premières cohortes de patients. Il est prévu que des études cliniques de phase 1/2 avec AEF0217 chez des sujets trisomiques démarrent au quatrième trimestre 2022. Ces études pourraient fournir des premiers résultats d’efficacité au premier semestre 2023. Ce programme clinique est réalisé dans le cadre du consortium « Improving COgnition in Down syndrome » (« ICOD ») en collaboration avec l’Institut Hospital del Mar d’Investigacions Mèdiques (« IMIM ») à Barcelone et d’autres centres cliniques européens. Le programme Horizon 2020 de l’Union Européenne a accordé au projet ICOD une subvention de 6 millions d’euros (H2020 Program N° 899986).
Aelis Farma envisage également d’étendre le programme clinique de phase 2 de AEF0217 à au moins un autre type de troubles cognitifs, par exemple ceux qui accompagnent le syndrome du X fragile ou le vieillissement, pour lesquels AEF0217 s’est montré efficace dans des modèles précliniques.
Aelis Farma entend développer ce composé de façon autonome au moins jusqu’à la fin du programme de phase 2 et, passé ce stade, amener le composé jusqu’à l’Autorisation de Mise sur le Marché (AMM), tout en restant ouverte à l’évaluation de partenariats potentiels.
Un partenariat mondial fortement créateur de valeur avec Indivior pour AEF0117 dans le traitement des troubles dus à la consommation excessive de cannabis
Sur la base des résultats de l’étude clinique de phase 2a de AEF0117, Aelis Farma a signé en juin 2021 un accord d’option de licence exclusive mondiale avec Indivior PLC (« Indivior »), société biopharmaceutique leader dans le traitement des addictions, pour le développement et la commercialisation de AEF0117 comme traitement des troubles liés à une consommation excessive de cannabis. Si l’étude de phase 2b s’avère positive, Aelis Farma et Indivior ont l’intention de démarrer des études de phase 3 fin 2024 ou début 2025, afin d’obtenir rapidement l’approbation aux Etats-Unis et en Europe.
Dans le cadre de cette collaboration, Aelis Farma a reçu 30 M$ (paiement de l’option). Si Indivior exerce l’option de licence à l’issue de la phase 2b, ce dernier versera à Aelis Farma 100 M$ liés à l’acquisition de la licence (potentiellement en 2024) puis jusqu’à 340 M$ supplémentaires en cas de franchissements d’étapes de développement, réglementaires et commerciales, ainsi que des redevances sur les ventes nettes de AEF0117 comprises entre 12% et 20%. Après l’exercice de l’option, tous les coûts de développement, d’enregistrement et de commercialisation de AEF0117 seront pris en charge par Indivior.
De plus, en janvier 2022, Aelis Farma a reçu un engagement irrévocable de souscription d’Indivior à hauteur de 11 M$ (soit environ 9,8 millions d’euros) à l’augmentation de capital devant intervenir dans le cadre de l’introduction en bourse des actions de la Société sur le marché réglementé d’Euronext Paris envisagée par la Société (voir ci-dessous § « Engagements de souscription reçus »).
Développement de nouveaux candidats-médicaments
Compte tenu de l’implication du récepteur CB1 dans de nombreuses pathologies et forte de sa bibliothèque diversifiée et exclusive de CB1-SSi, Aelis Farma développe également plusieurs nouvelles molécules CB1-SSi présentant des propriétés pharmacologiques différenciées.
Ces programmes se concentrent en priorité sur des indications orphelines, telles que le syndrome de délétion 22q11 ou certains troubles du spectre autistique (TSA), mais aussi sur des indications non orphelines telles que le trouble d’hyperactivité avec déficit de l’attention (TDAH). Aelis Farma entend démarrer le développement d’un nouveau candidat-médicament dans une de ces indications d’ici fin 2023.
Raisons de l’Offre
L’introduction en bourse d’Aelis Farma a pour objectif principal de financer les programmes de R&D de la Société dans le cadre du développement de médicaments pour les maladies du cerveau. Ainsi, le produit net de l’émission des Actions Nouvelles reçues dans le cadre de l’Offre, à hauteur d’environ 22,2 millions d’euros(susceptible d’être porté à environ 30,2 millions d’euros en cas d’exercice intégral à la fois de la Clause d’Extension et de l’Option de Surallocation), déduction faite des frais estimés liés à l’introduction en bourse, sera affecté selon la répartition suivante :
(i) environ 25% pour le développement du composé AEF0117 dans la thérapie des désordres dus à l’utilisation excessive du cannabis en effectuant les études complémentaires nécessaires à l’entrée en phase 3 à la fin de la phases 2b ;
(ii) environ 45% pour le développement du composé AEF0217 dans la thérapie des déficits cognitifs (i) pour effectuer les études complémentaires nécessaires à l’entrée en phase 3 à la fin de la phase 2b et (ii) pour explorer l’efficacité de l’AEF0217 dans d’autres déficits cognitifs ;
(iii) environ 30% pour développer et amener au stade clinique d’autres candidats médicaments aujourd’hui au stade de recherche et notamment ceux issus de la plateforme de recherche de la Société.
Dans le cas où l’offre ne serait souscrite qu’à hauteur de 75%, la Société procéderait aux arbitrages sur ses projets de développement : (i) le nombre des essais cliniques pour de nouvelles indications serait revu à la lumière des fonds disponibles et (ii) les dépenses associées aux frais généraux, administratifs et de fonctionnement en recherche et développement seraient adaptées pour soutenir ladite approche, tout en veillant à assurer la pérennité de la Société.
Structure de l’Offre
Il est prévu que la diffusion des actions offertes soit réalisée dans le cadre d’une offre globale (l’« Offre »), comprenant :
- une offre au public en France réalisée sous la forme d’une offre à prix ouvert, principalement destinée aux personnes physiques (l’« Offre à Prix Ouvert » ou « OPO »), étant précisé que les ordres seront décomposés en fraction d’ordre A1 (de 1 action jusqu’à 150 actions incluses) et fraction d’ordre A2 (au-delà de 150 actions) ; et
- un placement global principalement destiné aux investisseurs institutionnels (le « Placement Global») comportant :
– un placement en France ;
– un placement international dans certains pays, en dehors des Etats-Unis d’Amérique, en vertu de la Regulation S du U.S. Securities Act de 1933 (tel qu’amendé) (le « Securities Act ») et à l’exception, notamment, du Canada, de l’Australie, du Japon et de l’Afrique du Sud ; et
– un placement aux Etats-Unis au profit d’un nombre limité de « qualified institutional buyers » tel que ce terme est défini par la règle 144A du Securities Act, dans le cadre d’une exemption aux obligations d’enregistrement prévue pour les placements privés en vertu de l’article 4(a)(2) du Securities Act.
Si la demande exprimée dans le cadre de l’OPO le permet, le nombre d’actions allouées en réponse aux ordres émis dans le cadre de l’OPO sera au moins égal à 10 % du nombre d’actions offertes dans le cadre de l’Offre avant exercice éventuel de la clause d’extension et de l’Option de Surallocation.
Taille initiale de l’Offre
La Société émettra un nombre maximum de 1 783 167 actions ordinaires nouvelles (sur la base de la borne inférieure de la fourchette indicative de prix de l’Offre) d’une valeur nominale de 0,004 euro chacune pour un montant total de 25 millions d’euros (prime d’émission incluse) (hors exercice de la Clause d’Extension et de l’Option de Surallocation telles que définies ci-dessous) dans le cadre d’une augmentation de capital en numéraire avec suppression du droit préférentiel de souscription des actionnaires par voie d’offre au public.
Clause d’Extension
La Société pourra, en fonction de l’importance de la demande et après consultation avec Bryan Garnier & Co. Ltd., Bryan Garnier Securities et ODDO BHF SCA, agissant comme coordinateurs globaux et teneurs de livre associés dans le cadre de l’Offre (les « Coordinateurs Globaux et Teneurs de Livre Associés »), décider d’augmenter le nombre d’actions nouvelles initialement offertes (les « Actions Nouvelles Initiales ») d’un maximum de 15 %, soit d’un nombre maximum de 267 475 actions nouvelles supplémentaires (sur la base de la borne inférieure de la fourchette indicative de prix de l’Offre) (ensemble avec les Actions Nouvelles Initiales, les « Actions Nouvelles ») (la « Clause d’Extension »).
Option de Surallocation
La Société consentira à Bryan Garnier Securities agissant en qualité d’agent stabilisateur (l’« Agent Stabilisateur »), au nom et pour le compte des Coordinateurs Globaux et Teneurs de Livre Associés, une option permettant la souscription auprès de la Société d’un nombre d’actions représentant au total un maximum de 307 596 actions nouvelles additionnelles (sur la base de la borne inférieure de la fourchette indicative de prix de l’Offre et en cas d’exercice en totalité de la Clause d’Extension) (l’ « Option de Surallocation »). Pour les besoins des opérations de stabilisation, il est prévu qu’Inserm Transfert Initiative consentisse à l’Agent Stabilisateur un prêt de titres portant sur un maximum de 15% des Actions Nouvelles à émettre dans le cadre de l’augmentation de capital.
Fourchette indicative de prix
Le prix des actions offertes dans le cadre de l’OPO sera égal au prix des actions offertes dans le cadre du Placement Global (le « Prix de l’Offre »).
La fourchette indicative du Prix de l’Offre arrêtée par le conseil d’administration de la Société est comprise entre 14,02 et 16,82 euros par action. Cette fourchette du Prix de l’Offre est indicative et le Prix de l’Offre pourra être fixé en dehors de cette fourchette.
Montant de l’Offre
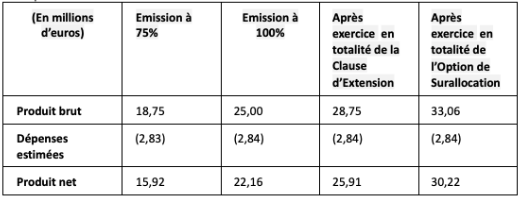
Le montant du produit brut de l’émission des Actions Nouvelles Initiales est d’environ 25 millions d’euros, pouvant être porté à un maximum d’environ 28,75 millions d’euros en cas d’exercice intégral de la Clause d’Extension, et à un maximum de 33,06 millions d’euros en cas d’exercice intégral de l’Option de Surallocation (sur la base de la borne inférieure de la fourchette indicative de prix).
Le montant du produit net de l’émission des Actions Nouvelles Initiales est estimé à environ 22,16 millions d’euros (environ 30,22 millions d’euros en cas d’exercice intégral de la Clause d’Extension et de l’Option de Surallocation).
Les dépenses liées à l’Offre à la charge de la Société sont estimées à environ 2,84 millions d’euros (2,84 millions d’euros en cas d’exercice intégral de la Clause d’Extension et de l’Option de Surallocation).
En cas d’insuffisance de la demande, l’augmentation de capital envisagée dans le cadre de l’Offre pourrait être limitée aux souscriptions reçues dès lors que celles-ci atteindraient 75% du montant de l’émission initialement prévue. En cas de réalisation de l’augmentation de capital à hauteur de 75% des Actions Nouvelles Initiales, le produit brut de l’émission s’élèverait à un montant d’environ 18,75 millions d’euros.
La rémunération maximale globale des intermédiaires financiers et les frais juridiques et administratifs liés à l’Offre à la charge de la Société pour le placement des actions offertes est estimée à environ 2,84 millions d’euros hors exercice de la Clause d’Extension et de l’Option de Surallocation, et environ 2,84 millions d’euros en cas d’exercice intégral de la Clause d’Extension et de l’Option de Surallocation.
Engagements de souscription reçus
La Société a reçu, au jour de l’approbation du prospectus, des engagements de souscription de la part de certains de ses actionnaires actuels (les « Actionnaires Historiques Ayant Souscrit des Engagements de Souscription ») à tout prix au sein de la fourchette indicative du Prix de l’Offre pour un montant total de 5,5 millions d’euros, réparti comme suit (montants à parfaire en fonction du Prix de l’Offre Globale) :
- Inserm Transfert Initiative (ITI) à concurrence de 0,5 million d’euros
- Aelis Innovation, fonds représenté par la société de gestion Irdi Capital Investissement à concurrence de 1 million d’euros
- Nouvelle Aquitaine Co-Investissement (NACO) à concurrence de 1,392 million d’euros
- Aqui-Invest à concurrence de 0,454 million d’euros
- Aquitaine Création Investissement (ACI) à concurrence de 1,154 million d’euros
- Bpifrance à concurrence de 1 million d’euros
Il est précisé que parmi les Actionnaires Historiques Ayant Souscrit des Engagements de Souscription, Inserm Transfert Initiative est également censeur. La conclusion des engagements de souscription de certains desdits Actionnaires Historiques a été préalablement approuvée par le Conseil d’administration de la Société.
La société Indivior s’est par ailleurs engagée à souscrire à l’Offre à tout prix pour un montant de approximativement 9,8 millions d’euros (correspondant à 11 millions de dollars), soit à environ 39,3% de l’Offre, hors exercice de la Clause d’Extension et de l’Option de Surallocation.
DNCA Finance, agissant pour le compte du fonds DNCA Actions Euro Micro Caps, s’est également engagée à souscrire à l’Offre à tout prix pour un montant de 1,2 million d’euros.
L’ensemble des engagements de souscription reçus représentent 16,54 millions d’euros, soit environ 66,1% du montant brut de l’Offre (hors exercice de la Clause d’Extension et de l’Option de Surallocation) et 88,2% du montant réalisé en cas d’émission à hauteur de 75% du montant de l’émission initialement prévue.
Engagements d’abstention et de conservation des titres
La Société a pris un engagement d’abstention d’émission de titres de capital d’une durée de 180 jours calendaires suivant la date de règlement-livraison de l’Offre, sous réserve de certaines exceptions usuelles.
L’ensemble des actionnaires de la Société représentant 100% du capital de la Société avant l’Offre ainsi que les cadres et dirigeants de la Société porteurs de BSA et de BSPCE ont pris un engagement de conservation des actions de la Société qu’ils détiennent ou, en cas d’exercices de BSPCE ou de BSA, qu’ils pourraient être amenés à détenir, pendant une durée de 365 jours calendaires suivant la date de règlement-livraison de l’Offre, sous réserve de certaines exceptions usuelles.
Il est précisé que les Actionnaires Historiques Ayant Souscrit des Engagements de Souscription ont chacun souscrit un engagement de conservation de 365 jours calendaires suivant la date de règlement livraison de l’Offre à la fois pour les actions existantes et pour les Actions Issues de la Conversion des OC sous réserve de l’accord écrit des Coordinateurs Globaux et Teneurs de Livre et de certaines exceptions usuelles.
Indivior a pour sa part souscrit un engagement de conservation de 365 jours calendaires suivant la date de règlement-livraison de l’Offre pour les actions nouvelles souscrites par lui dans le cadre de l’Offre.
Calendrier indicatif de l’opération
> 1er février 2022 Approbation du Prospectus par l’AMF
> 2 février 2022 Diffusion du communiqué de presse annonçant l’Offre et la mise à disposition du Prospectus
Ouverture de l’OPO et du Placement Global
> 14 février 2022 Clôture de l’OPO à 17 heures (heure de Paris) pour les ordres aux guichets et à 20 heures (heure de Paris) pour les ordres par Internet
> 15 février 2022 Clôture du Placement Global à 12 heures (heure de Paris) Fixation du Prix de l’Offre
Diffusion du communiqué de presse indiquant le Prix de l’Offre
Première cotation des actions de la Société sur Euronext Paris
Début de la période de stabilisation éventuelle.
> 17 février 2022 Règlement-livraison de l’OPO et du Placement Global
18 février 2022 Début des négociations des actions de la Société sur Euronext Paris sur une ligne de cotation intitulée « Aelis Farma »
17 mars 2022 Date limite d’exercice de l’Option de Surallocation
Fin de la période de stabilisation éventuelle
Modalités de souscription et d’achat
Les personnes désirant participer à l’OPO devront déposer leurs ordres auprès d’un intermédiaire financier habilité en France, au plus tard le 14 février à 17 heures (heure de Paris) pour les ordres aux guichets et à 20 heures (heure de Paris) pour les ordres par Internet, si cette possibilité leur est donnée par leur intermédiaire financier.
Pour être pris en compte, les ordres d’achat et de souscription émis dans le cadre du Placement Global devront être reçus par l’un ou plusieurs des Coordinateurs Globaux et Teneurs de Livre Associés au plus tard le 15 février à 12 heures (heure de Paris), sauf clôture anticipée.
Révocation des ordres d’achat et de souscription
Les ordres de souscription passés dans le cadre de l’OPO seront révocables. Les modalités pratiques de révocation des ordres sont déterminées par chaque intermédiaire financier. Il appartient donc aux investisseurs de se rapprocher de leur intermédiaire financier pour connaître ces modalités
Tout ordre d’achat et de souscription émis dans le cadre du Placement Global pourra être révoqué auprès des Coordinateurs globaux et Teneurs de Livre Associés ayant reçu cet ordre d’achat et de souscription et ce jusqu’au 15 février à 12 heures (heure de Paris), sauf clôture anticipée ou prorogation.
Eligibilité de l’Offre aux PEA et PEA-PME et label « Entreprise Innovante »
Aelis Farma estime respecter les critères d’éligibilité au dispositif PEA PME-ETI précisés par les dispositions des articles L. 221-32-2 et D.221-113-5 et suivants du Code monétaire et financier. En conséquence, les actions Aelis Farma peuvent être intégrées au sein des plans d’épargne en actions (PEA) et des comptes PEA PME-ETI, qui bénéficient des mêmes avantages fiscaux que le PEA classique.
Aelis Farma est par ailleurs labellisée « Entreprise innovante » par Bpifrance
Codes d’identification des titres Aelis Farma
- Libellé : Aelis Farma
- Code ISIN : FR0014007ZB4
- Mnémonique : AELIS
- Marché de cotation : Euronext Paris (Compartiment B)
- Secteur d’activité – Classification ICB : Biotechnologie – 20103010
- Eligibilité aux dispositifs PEA et PEA-PME et 150-0 B ter du CGI (remploi de plus-value de cession), et qualification Bpifrance Entreprise innovante
Intermédiaires financiers et conseils

Mise à disposition du Prospectus
Des exemplaires du prospectus approuvé par l’AMF le 1er février 2022 sous le numéro 22-021, composé du document d’enregistrement approuvé le 14 janvier 2022 sous le numéro I. 22-003, et d’une note d’opération (incluant le résumé du prospectus), sont disponibles sans frais auprès d’Aelis Farma, ainsi que sur les sites Internet d’Aelis Farma (www.aelis-finance.com) et de l’AMF (www.amf-france.org).
Aelis Farma attire l’attention du public sur la section 3 « Facteurs de risques » du document d’enregistrement approuvé par l’AMF et sur le chapitre 2 « Facteurs de risques » de la note d’opération. La réalisation d’un ou plusieurs de ces risques est susceptible d’avoir un effet défavorable significatif sur les activités, la réputation, la situation financière, les résultats ou les perspectives du Groupe, ainsi que le prix de marché des actions d’Aelis Farma.
A propos d’AELIS FARMA
Fondée en 2013, Aelis Farma est une société biopharmaceutique à l’origine d’une nouvelle classe de médicaments, les inhibiteurs spécifiques de la signalisation du récepteur CB1 du système endocannabinoïde (les CB1-SSi). Ces nouvelles molécules recèlent un fort potentiel dans le traitement de nombreuses maladies du cerveau. Les CB1-SSi ont été développés par Aelis Farma sur la base de la découverte d’un nouveau mécanisme naturel de défense du cerveau effectuée par l’équipe du Dr. Pier Vincenzo Piazza, Directeur Général de la Société, lorsqu’il était directeur du Neurocentre Magendie de l’Inserm à Bordeaux. Pour ces découvertes, le Dr. Piazza s’est vu attribuer le grand prix de l’Inserm et le grand prix de neurologie de l’Académie des Sciences qui sont parmi les prix français les plus prestigieux en médicine et neurologie.
Aelis Farma développe deux candidats-médicaments « first-in-class » aujourd’hui au stade clinique, AEF0117 et AEF0217, et dispose d’un portefeuille de CB1-SSi innovants pour le traitement d’autres pathologies associées aux dérèglements de l’activité du récepteur CB1.
AEF0117, qui cible les troubles liés à la consommation excessive de cannabis (addiction et psychose), a terminé une étude de phase 2a qui a révélé des signaux positifs d’efficacité et entrera en phase 2b aux Etats-Unis en 2022. Aelis Farma bénéficie d’un accord d’option de licence exclusive avec Indivior PLC, groupe pharmaceutique leader dans le traitement des addictions, pour le développement et la commercialisation de AEF0117 dans les troubles liés à la consommation excessive de cannabis. Dans le cadre de cette collaboration, Aelis Farma a reçu 30 M$ (paiement de l’option). Si Indivior exerce l’option de licence à l’issue de la phase 2b, Aelis Farma recevra 100 M$ liés à l’acquisition de la licence (potentiellement en 2024) puis jusqu’à 340 M$ de paiements supplémentaires conditionnés aux franchissements d’étapes de développement, réglementaires et commerciales, ainsi que des redevances sur les ventes nettes de AEF0117 comprises entre 12% et 20%. AEF0217, qui cible différents troubles cognitifs dont ceux associés au syndrome de Down, progresse avec succès dans son programme de phase 1/2 et pourrait fournir les premières preuves d’efficacité en début 2023. Ce composé a fait l’objet d’études de preuve de concept préclinique très étendues en utilisant des tests évaluant les fonctions cognitives, très innovants et à fort pouvoir prédictif. Dans ce contexte, AEF0217 a montré sa capacité à reverser de façon complète les déficits dans plusieurs modèles de troubles cognitifs tels que les syndromes de Down et du X fragile, ainsi que dans certains déficits cognitifs qui accompagnent le vieillissement.
Basée à Bordeaux, au sein du Neurocentre Magendie, Aelis Farma s’appuie sur les talents de 24 collaborateurs hautement qualifiés et a bénéficié d’investissements de la Région Nouvelle-Aquitaine, d’Inserm Transfert Initiative, de Bpifrance, des fonds régionaux ACI, NACO et Aqui-invest et de IRDI Capital Investissement.
Pour plus d’informations : www.aelisfarma.com
Contacts
AELIS FARMA
NewCap
Pier Vincenzo Piazza
Co-fondateur et Directeur Général
contact@aelisfarma.com
Dusan Oresansky/Marine de Fages
Relations investisseurs
aelis@newcap.eu
+33 1 44 71 94 92
Nicolas Merigeau
Relations médias
nmerigeau@newcap.fr
+33 1 44 71 94 98


